杨丽梅1,2,马力1,2,郭时金1,2,王艳1,张颖1,2,
王艳萍1,2,沈志强1*,徐倩倩1,2,张志美1,2
(1.山东省滨州畜牧兽医研究院,山东滨州256600;
2.山东绿都安特动物药业有限公司,山东滨州256600)
摘 要:2010年坦布苏病毒病对我国南方地区的鸭养殖业造成重大损失,文章对该病的病原学、病理学、流行病学、诊断技术、疫苗研发等的研究现状与前景进行了综述。
关键词:坦布苏病毒;禽;诊断;疫苗
2010年春季,我国南方的福建、浙江等养鸭业比较密集的地区首先暴发了一种引以鸭产蛋急剧下降、出现神经症状为主要临床特征,以出血性卵巢炎为主要病理变化特征的急性、烈性传染病[1,2]。
该病发病急、传播快、迅速蔓延至全国[3]。随之,研究学者迅速开展针对本次疫病的各项研究工作,现已确定该疫病由黄病毒科(Flaviviridae)黄病毒属(Flavivirus)的禽坦布苏病毒(AvianTembusu virus,ATMUV)引起。该病毒除感染鸭外,还可感染鸡、鹅等禽类[4],给我国养禽业造成了巨大的经济损失[5]。本文就目前对禽坦布苏病毒病(Avian Tembusu virus disease,ATMUVD)的病原学、病理学、流行病学、诊断技术、疫苗等方面的研究现状与发展前景作一综述,以期为我国ATMUVD的诊断与综合防控提供合理的科学依据。
1 病原学
ATMUV为直径50~100nm、有囊膜的单股RNA病毒[6],对酸敏感、能耐受pH9.0的碱性环境,50℃1h即失去感染能力[7]。对鸡、鸭、鹅、鸽、鼠、兔、猪和人的红细胞无凝集性[1,6];对鸭胚、鸡胚的致死率达100%[6,7],在鸭胚成纤维细胞上能产生典型的细胞病变[6]。
李玉峰等[6]利用随机引物进行RT-PCR与序列分析,确定分离病毒属于黄病毒属。黄欣梅等[8]设计特异性引物扩增出985bp黄病毒属E基因片段,该片段与坦布苏病毒E基因的核苷酸同源性为91%,氨基酸同源性为97%,确定分离病毒为坦布苏病毒。Tang等[9]、Zhu等[10]和张琳等[12]分别对分离到的ATMUV进行遗传变异分析,结果显示国内2010年以来分离到的ATMUV核苷酸序列同源性在99%以上,存在散在的碱基突变,但没有碱基缺失和插入现象,表明我国流行的ATMUV比较稳定。ATMUVD致病原的确定、病毒的生物学特性与遗传变异分析为我国学者迅速开展其致病机理、传播机制、分子流行病学研究,研制新型诊断试剂与疫苗以及制定相关综合防控措施奠定了重要基础。
2 病理学
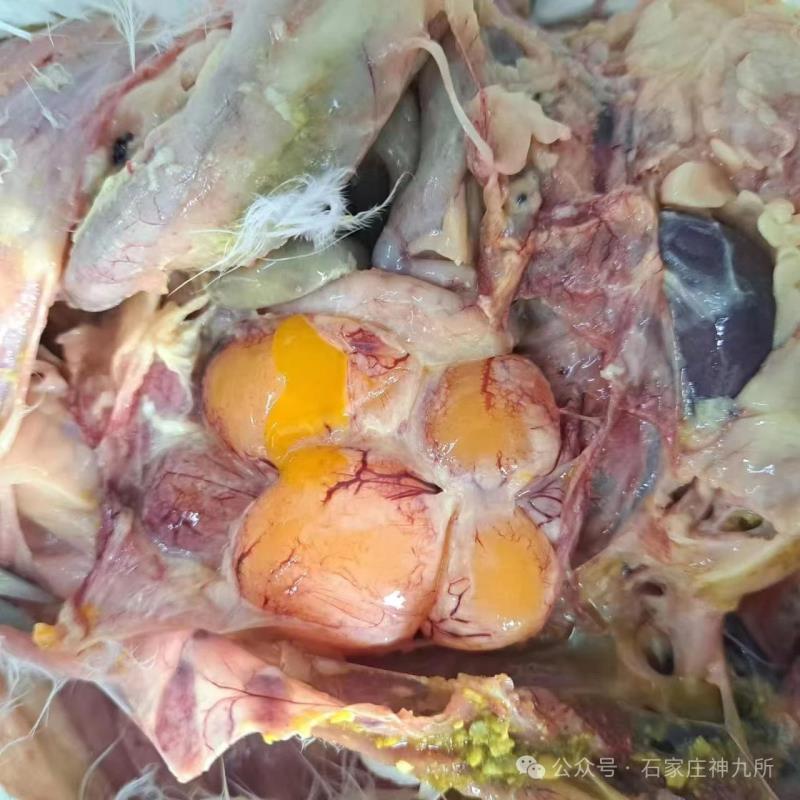
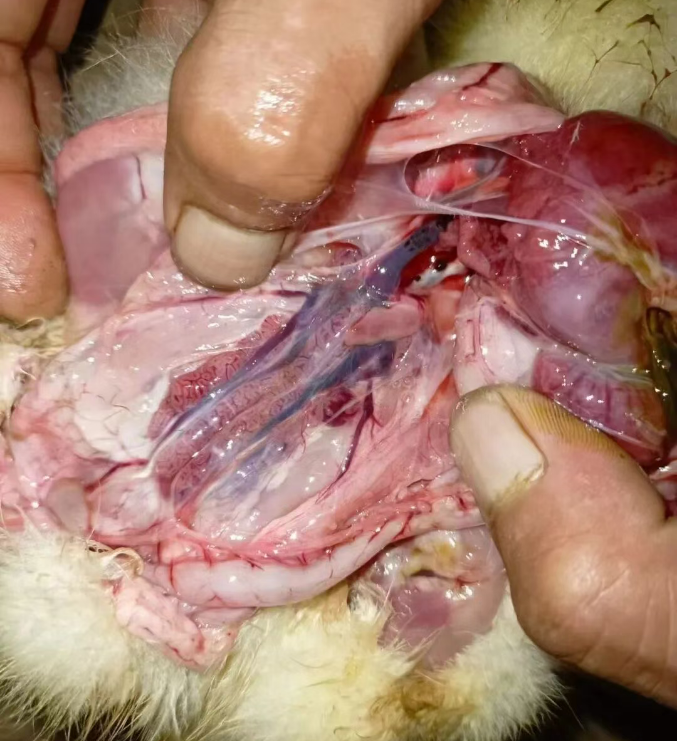
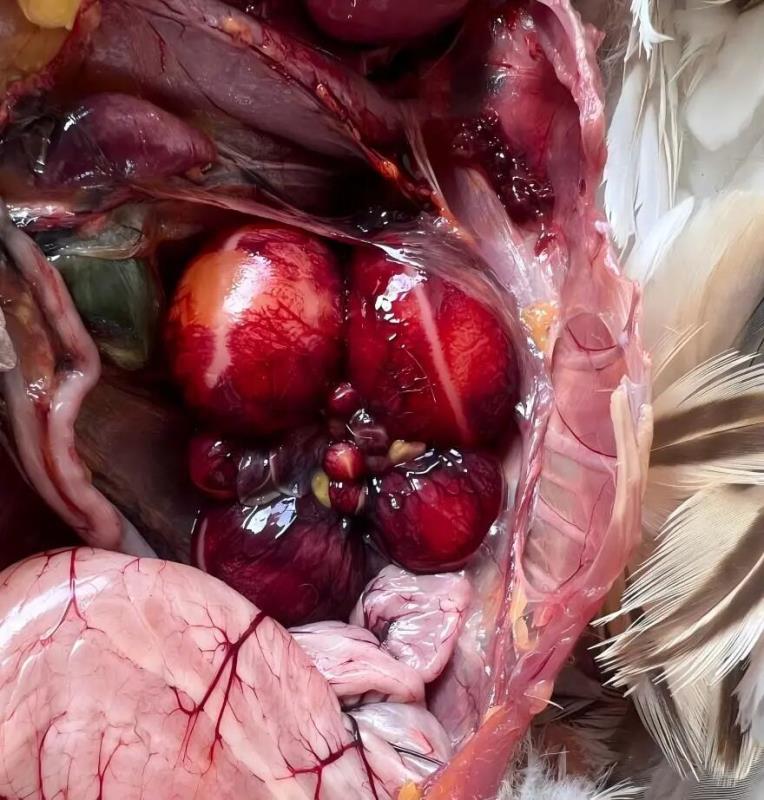
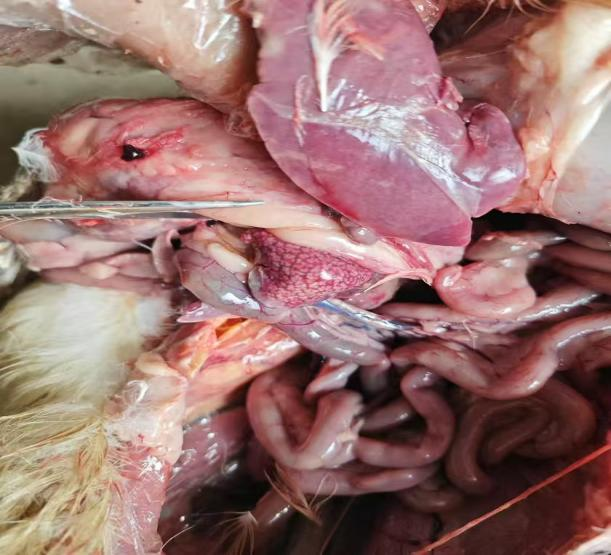
ATMUV可造成动物机体全身多器官的病理性损伤,主要表现在卵泡膜充血、出血[5];卵泡变性、坏死[12];肺淤血、内有大量细胞渗出[13];肝脏淤血、肿大、坏死[12];脑膜充血、水肿、部分有炎性细胞浸润[13];脾脏肿大[12];肾小管上皮细胞肿胀[13];胰腺中可见凝固性坏死灶[13]。病鸭肝细胞呈现严重的脂肪变性,低倍镜下可见肝脏结构中充满空泡,血管内红细胞溶血,部分淋巴细胞渗出和增生[12]。ATMUVD的病理学阐明了ATMUV感染的形态结构与功能代谢变化,为认识和掌握ATMUV发生发展规律、致病机理以及为ATMUVD的临床诊断提供重要的依据。
3 流行病学
ATMUVD发病率高,感染宿主范围广,现已有从发病鸭、鸡、鹅体内成功分离并鉴定的报道[1,7,14]。因ATMUV本质属于蚊虫传媒病毒,提示该病毒可能会经蚊子等传播,但迄今为止还没有蚊虫传播该病毒的报道。赵冬敏等[15]研究表明该病毒可以垂直传播。陈雷等[16]对ATMUV感染后不同时间采集的泄殖腔棉拭子进行RT-PCR检测,结果显示感染后第一天即能检测到该病毒核酸,表明感染动物可经粪便排毒,病毒污染的饲料、饮水、器具等在不同地区调运,极易造成该病的快速传播与大范围流行。ATMUVD的流行病学研究阐明了ATMUV的流行特点与规律,为合理预防、控制甚至消灭ATMUV起到了重要作用。
4 诊断技术
4.1 病毒分离
病毒分离一直是动物病毒病经典、准确的诊断方法,对于ATMUV而言,卵泡膜、肝脏、脾脏等病变组织均可作为病毒分离的样品,鸡胚、鸭胚、鸭胚成纤维细胞均可用于病毒的增殖。目前,已有多株鸭源、鸡源、鹅源坦布苏病毒成功分离的报道[1,4,7,8,14,15]。病毒分离方法准确性高、可靠性强,但试验周期较长、操作较复杂,且分离到的病毒需要电镜、PCR等方法进行后续鉴定,故该方法只适合有一定技术条件的实验室应用。
4.2 RT-PCR
方法简单、快速、敏感、特异,在ATMUV的快速诊断中得到了广泛应用。李国平等[17]建立的检测ATMUV的RT-PCR方法检测Ⅰ型鸭肝炎病毒、新城疫病毒、减蛋综合征病毒、鸭肠炎病毒均为阴性,敏感性达1ng RNA。黄欣梅等[18]建立的检测ATMUV的套式RT-PCR方法的灵敏度达101.89TCID50/0.1mL,比常规RT-PCR方法的敏感性高1000倍,应用该方法对疑似ATMUV感染的70份鹅病料、4份鸭病料、12份鸡病料进行检测,总阳性率达58.14%,明显高于常规RT-PCR方法检测的阳性率(17.44%)。RT-PCR方法具有良好的特异性、敏感性、重复性,而套式RT-PCR方法具有更高的敏感性,该方法操作简单、检测快速、费用较低,适合普通实验室使用,是目前一般实验室进行ATMUV病原检测、分子流行病学调查等广泛采用的分子生物学诊断技术。
4.3 荧光定量RT-PCR
荧光定量PCR技术将光谱技术融合至PCR扩增反应中,实现了PCR扩增反应的实时跟踪和定量检测。Yan等[19]根据ATMUVE基因序列设计引物与探针,建立的检测ATMUV的荧光定量RT-PCR方法的灵敏度比常规RT-PCR方法高100倍,检测常见禽病病毒均为阴性。Yun等[20]建立的检测ATMUV的荧光定量RT-PCR方法,包括核酸的提取过程在内,2h内即可完成。高凤等[21]建立的ATMUV荧光定量RT-PCR方法对鸭病毒性肝炎病毒、禽流感病毒、新城疫病毒、腺病毒、鸭瘟病毒、猪乙脑病毒的检测均为阴性,与病毒分离鉴定的符合率高达100%。荧光定量RT-PCR方法具有灵敏度高、特异性强、全封闭反应、耗时短等优点,但该方法所需试剂与仪器均较昂贵,且对操作人员要求较高,限制了其在基层及一般实验室的普遍应用,但省级以上重点实验室可采用该方法进行ATMUV的定量检测与快速诊断。
4.4 RT-LAMP
环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)无需特殊仪器设备、肉眼判读、操作简单、特别适合基层兽医部门应用。
Wang等[22]建立的可视化检测ATMUV的RT-LAMP方法在63℃水浴50min内即可完成扩增,敏感性达2拷贝/μL。Tang等[23]建立的ATMUVRT-LAMP方法灵敏度达45拷贝/μL,检测常见10种禽病病毒均为阴性。李兆龙等[5]建立的ATMUVRT-LAMP方法在常规水浴锅中45min内即可完成,灵敏度达1pg,比常规RT-PCR方法高100倍。RT-LAMP方法本质是一种核酸扩增检测方法,故具有极高的敏感性与特异性,且该方法简便、快速、无需特殊仪器设备,特别适合基层兽医部门使用,具有广阔的应用前景。
4.5 血清学抗体检测
检测抗体可以了解群体ATMUV的感染情况,为制定合理的防制措施提供参考。姬希文等[24]建立的ATMUV间接ELISA方法检测常见禽病病原阳性血清均为阴性,批内和批间重复试验的变异系数分别小于2.9%和3.9%,应用该方法与琼脂扩散试验同时检测140份血清样品,间接ELISA检测出阳性108份,琼扩试验检测出阳性32份。但该方法以纯化的全病毒作为诊断抗原,存在散毒的潜在危险,故利用基因工程方法获得病毒保护性抗原逐渐得到发展和重视,郝明飞等[25]以原核表达的重组E蛋白为诊断抗原,建立了检测ATMUV抗体的间接ELISA方法。Li等[26]以ATMUVE蛋白单克隆抗体为阻断抗体,建立了检测ATMUV抗体的液相阻断ELISA方法,该方法与鸡胚中和试验方法的符合率高达70.6%。血清学抗体检测方法高通量、操作简单、检测快速、特异性强、敏感性高,可以作为ATMUV的快速诊断与流行病学调查的一种有效方法。
5 疫苗
5.1 灭活疫苗
万春和等[27]制备的ATMUV油乳剂灭活疫苗具有良好的安全性、无毒副作用,能够有效保护ATMUV野毒的攻击。李振华等[28]也制备了ATMUV灭活油乳苗,将10日龄雏鸭分成4组,分别免疫PBS、0.2mL、0.5mL和0.8mL疫苗,并于免疫后28d攻毒。结果显示,0.5mL组抗体水平及T淋巴细胞数量与对照组相比差异均极显著(P<0.01),0.2mL组免疫功毒保护率为80%,0.5mL和0.8mL组免疫功毒保护率均为100%,而PBS对照组雏鸭均表现为典型的ATMUV感染症状,其中3只死亡。ATMUVD灭活疫苗具有良好的安全性和免疫保护效果,为ATMUVD灭活疫苗的研制开发与推广应用提供了参考依据。灭活疫苗作为最经典的疫苗,具有易保存、有效期长等优点,但灭活疫苗免疫剂量较大,且只产生体液免疫,产生的免疫力较低,免疫持续时间较短。因ATMUVD为新发病,故灭活疫苗成为能够最快实现产业化生产的疫苗。
5.2 基因工程疫苗
E蛋白是坦布苏病毒的囊膜蛋白,具有良好的免疫原性,是ATMUV主要的保护性抗原,且参与病毒的细胞膜融合和穿入,与病毒的致病性密切相关。徐大伟等[29]将ATMUVE基因克隆于真核表达载体pCAGGS中,构建了编码E基因的真核表达重组质粒pCAGGS-E,将pCAGGS-E尾静脉注射免疫BALB/c小鼠,间接ELISA检测表明随着免疫次数的增加及免疫时间的延长,小鼠的抗体滴度逐渐升高。该研究表明构建的ATMUVE基因核酸疫苗免疫小鼠后,能够激发小鼠产生高水平的抗体,但该疫苗对鸭的免疫效力需进一步验证。基因工程疫苗是在现代免疫学、生物化学、分子生物学等基础上研制成功的新型疫苗,能同时刺激机体产生细胞免疫和体液免疫,具有安全、高效、廉价、多价等优点,其潜在的应用价值不可估量,但目前只是在研究阶段,距规模化生产和产业化应用还有很长的一段时间。
6 结语
ATMUVD自2010年4月份在我国首次暴发后,研究学者反应迅速,在短短3年的时间里对该病的病原学、病理学、流行病学、诊断技术、疫苗等方面的研究均取得了突破性进展,明确了ATMUV的生物学特性与遗传变异规律,阐明了其病理学变化特征以及流行特点与规律,建立诸多分子生物学与血清学诊断方法,研制了灭活疫苗和基因工程疫苗。下一步的研究重点将是加强ATMUV结构蛋白与非结构蛋白的特征与功能性研究、致病机理、跨物种传播机制等基础性研究,同时应利用反向遗传操作技术构建感染性克隆和研制新型弱毒疫苗,加强诊断技术与灭活疫苗的推广与临床应用等。随着研究学者的不断努力,AT⁃MUV的基因组学、致病机理、传播机制、新型疫苗与诊断试剂等研究必将日趋成熟和完善,从而为我国ATMUVD的预防和控制提供更加合理的科学依据。
发病后:确实有效的防控方案:水禽疫病防治网 特聘禽病专家魏老师,针对当前水禽(鸭、鹅)黄病毒(发热、减料、拉白痢、瘫痪、种鸭产蛋下降)混合感染,造成大批死亡现象,魏老师推出---“四个一”方案 =(1+1+1+1)特制板青颗粒A+好得快+新力欣或新泰瑞+优免或新力爽,
将全天用量集中1次在三个小时饮完,连用4-5天。对于个别严重的卧在地上不愿走动,基本不能喝水吃料的,用泰灭净+清开灵+力克舒联合皮下注射。24-48小时见效!此方案已在全国多地使用,已成功治疗数万例病例,为众多养殖场挽回了巨大的经济损失。(水禽疫病解决专家--魏老师 13939027068)
参考文献:
1 曹贞贞,张存,黄瑜,等. 鸭出血性卵巢炎的初步研究[J]. 中国兽医杂志,2010,46(12):3-6.
2 Yan P,Zhao Y,Zhang X,et al. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China[J].Virology,2011,417(1):1-8.
3 Tang Y,Diao Y,Yu C,et al. Characterization of a Tembusuvirus isolated from naturally infected house sparrows(Passer domesticus)in Northern China[J]. Transbound Emerg Dis,2013,60(2):152-158.
4 Liu M,Chen S,Chen Y,et al. Adapted Tembusu-like virusin chickens and geese in China[J]. J Clin Microbiol,2012,50(8):2807-2809.
5 李兆龙,陈仕龙,林锋强,等. 禽新型黄病毒RT-LAMP检测方法的建立[J].畜牧兽医学报,2012,43(4):659-663.
6 李玉峰,马秀丽,于可响,等. 一种从鸭新分离的黄病毒研究初报[J].畜牧兽医学报,2011,42(6):885-891.
7 陈仕龙,陈少莺,王劭,等. 一种引起蛋鸡产蛋下降的新型黄病毒的分离与初步鉴定[J].福建农业学报,2011,26(2):170-174.
8 黄欣梅,李银,赵冬敏,等. 新型鹅黄病毒JS804毒株的分离与鉴定[J].江苏农业学报,2011,27(2):354-360.
9 Tang Y,Diao Y,Gao X,et al. Analysis of the complete ge⁃nome of Tembusu virus,a flavivirus isolated from ducks in China[J].Transbound Emerg Dis,2012,59(4):336-343.10 Zhu W,Chen J,Wei C,et al. Complete genome sequence of duck Tembusu virus,isolated from Muscovy ducks in southern China[J].J Virol,2012,86(23):13119.
11 张琳,逯茂洋,胡北侠,等. 4株鸭坦布苏病毒包膜蛋白基因的分子进化分析及表达[J].中国兽医学报,2013,33(2):175-179.
12 刘浩飞,黄显明,张小飞,等. 鸭黄病毒病的临床病理学观察及病原学检测[J].畜牧与兽医,2013,45(2):25-28.
13 王友令,袁小远,杨金兴,等. 1株鸭坦布苏病毒人工感染雏鸭的病理学研究[J].畜牧兽医学报,2013,44(1):66-70.
14 Huang X,Han K,Zhao D,et al. Identification and molecular characterization of a novel flavivirus isolated from geese in China[J].Res Vet Sci,2013,94(3):774-780.
15 赵冬敏,黄欣梅,刘宇卓,等. 新型黄病毒在种鹅中垂直传播的研究[J].南方农业学报,2012,43(1):99-102.
16 陈雷,傅光华,黄瑜,等. 鸭坦布苏病毒在雏麻鸭体内的分布及排毒[J].中国动物传染病学报,2013,21(2):24-28.
17 李国平. 鸭坦布苏病毒RT-PCR诊断方法的建立与应用[J].中国畜牧兽医,2013,40(1):69-71.
18 黄欣梅,赵冬敏,刘宇卓,等. 禽黄病毒套式RT-PCR检测方法的建立及应用[J].畜牧与兽医,2012,44(6):5-8.
19 Yan L,Yan P,Zhou J,et al. Establishing a TaqMan-based real- time PCR assay for the rapid detection and quantification of the newly emerged duck Tembusu virus[J]. Virol J,2011,8:464.
20 Yun T,Ni Z,Hua J,et al. Development of a one-step realtime RT- PCR assay using a minor- groove- binding probe for the detection of duck Tembusu virus [J]. J Virol Methods,2012,181(2):148-154.
21 高凤,于可响,马秀丽,等. 鸭黄病毒荧光定量RT-PCR检测方法的建立及应用[J].中国兽医学报,2013,33(1):16-19.
22 Wang Y,Yuan X,Li Y,et al. Rapid detection of newly isolated Tembusu-related Flavivirus by reverse-transcription loopmediated isothermal amplification assay[J].Virol J,2011,8:553.
23 Tang Y,Diao Y,Yu C,et al. Rapid Detection of Tembusu Virus by Reverse- Transcription,Loop- mediated Isothermal Amplification(RT-LAMP)[J]. Transbound Emerg Dis,2012,59(3):208-213.
24 姬希文,闫丽萍,颜丕熙,等. 鸭坦布苏病毒抗体间接ELISA检测方法的建立[J].中国预防兽医学报,2011,33(8):630-634.
25 郝明飞,张琳,胡北侠,等. 鸭坦布苏病毒包膜蛋白的原核表达和间接ELISA抗体检测方法的建立[J]. 动物医学进展,2012,
33(12):17-22.26 Li X,Li G,Teng Q,et al. Development of a blocking ELISA for detection of serum neutralizing antibodies against newly emerged duck Tembusu virus[J].PLOS One,2012,7(12):53026.
27 万春和,施少华,傅光华,等. 鸭黄病毒油乳剂灭活疫苗研制及免疫效果测定[J].养禽与禽病防治,2011,10:20-22.
28 李振华,李小康,郭香玲,等. 鸭坦布苏病毒灭活油乳苗的制备及免疫效力测定[J].中国预防兽医学报,2013,35(5):388-391.
29 徐大伟,李国新,李雪松,等. 鸭坦布苏病毒E基因DNA疫苗构建及免疫原性的初步研究[J]. 中国预防兽医学报,2012,34(4):305-308.
鸡鸭鹅病防治网 为规模化养殖企业(场)提供疫病防控最佳解决方案!!!
禽病实战专家咨询:13939027068 (技术总监-魏老师)博客:http://blog.sina.com.cn/gallopsbj
养殖安880、蚊蝇一喷净等产品销售顾问:成龙 13838248089 博客: http://lyrswcl.blog.163.com
来源:鸡鸭鹅病防治网 分享 www.jyebfz.com

发表评论共有0访客发表了评论
暂无评论,快来抢沙发吧!